Rev. Fac. Agron. (LUZ). 1998, 15: 319-329
Obtainment of antiserum against bean southern mosaic virus through a simple methodology
Recibido el 27-10-1997lAceptado el
20-04-1998
1. Parte del Trabajo Especial de Grado presentado por el primer autor para optar al
T�tulo de Ingeniero Agr�nomo en la Facultad de Agronom�a de la Universidad Central de
Venezuela.
2. Dirigir correspondencia a: Prof. Mario Jos� Garrido, Universidad Central de Venezuela,
Facultad de Agronom�a, Instituto de Bot�nica Agr�cola, Secci�n de Fitopatolog�a,
Apartado 4579, Maracay 2101-A, Venezuela.
Resumen
Palabras claves: Virus, purificaci�n, antisuero, caraota, Phaseolus vulgaris.
Abstract
Key words: Virus, purification, antiserum, bean, Phaseolus vulgaris.
Introducci�n
La caraota (Phaseolus vulgaris L.) es la leguminosa de mayor importancia destinada al consumo directo de la poblaci�n en Venezuela. Este cultivo es afectado por numerosos pat�genos, entre los cuales los virus revisten especial inter�s debido a las p�rdidas que ocasionan y porque el control qu�mico de los mismos es generalmente ineficaz (9).
M�s de cuarenta virus han sido reportados infectando a la caraota, de los cuales el virus del mosaico sure�o de la caraota (bean southern mosaic virus: BSMV) es uno de los m�s diseminados mundialmente. Esta virosis puede causar p�rdidas considerables en el rendimiento (m�s del 50%), debido a la reducci�n del n�mero y peso de la semilla producida por las plantas de caraota infectadas (9). En Venezuela es poca la informaci�n existente sobre este virus y su incidencia se ha incrementado notablemente en los �ltimos a�os, particularmente en el estado Aragua (8, 12).
Una v�a r�pida y segura de identificar los virus de plantas es a trav�s de pruebas serol�gicas. Sin embargo, para este tipo de prueba se requieren antisueros espec�ficos, y para producirlos se necesitan insumos y equipos de costo elevado (15). Esta situaci�n ha obligado, en la mayor�a de los casos, a que en nuestro pa�s deban importarse antisueros a un precio alto, lo cual dificulta los trabajos de diagn�stico y epidemiol�gicos, no s�lo en caraota, sino tambi�n en otros cultivos. Lo anterior se debe, fundamentalmente, a la escasez de laboratorios de virolog�a dotados de los equipos y materiales requeridos para este tipo de trabajo.
En Venezuela se han realizado algunas investigaciones dirigidas a la obtenci�n de antisueros mediante esquemas sencillos de purificaci�n con resultados muy halagadores (1, 11, 14).
Estos protocolos, desarrollados para algunos virus de inter�s en el pa�s, podr�an ser utilizados en laboratorios con limitaciones de equipos, no s�lo en Venezuela, sino tambi�n en otros pa�ses con limitaciones econ�micas o en v�as de desarrollo.
En atenci�n a lo antes expuesto, y en vista de la importancia que tiene la caraota en nuestro pa�s, se consider� de inter�s realizar esta investigaci�n, cuyo objetivo fue obtener antisuero contra el BSMV mediante la implementaci�n de una metodolog�a sencilla de purificaci�n.
Materiales y m�todos
Fuente de virus y mantenimiento de plantas. Como fuente del virus fueron utilizadas plantas de caraota cv Tacarigua infectadas mec�nicamente con un aislado identificado previamente como BSMV raza B (BSMV-B) (12).
Las semillas fueron sembradas en una mezcla est�ril de suelo y arena, en proporci�n 3:1 (v/v), respectivamente, contenida en materos pl�sticos de 1 L de capacidad (4-5 semillas/matero). Las plantas se inocularon mec�nicamente (10) a los 7-8 d�as de edad y se mantuvieron en un umbr�culo libre de insectos, a 26-28 �C y 65-70% HR, donde fueron regadas diariamente, cada 15 d�as fertilizadas con una soluci�n de una f�rmula completa (16-16-08; 2-3 g/L) y como medida preventiva adicional se efectuaron aplicaciones semanales (1/2 dosis comercial) de insecticida (Anthio), acaricida (Omite) y fungicida (Polyram-Combi), permitiendo mantenerlas en un estado �ptimo de crecimiento.
Purificaci�n parcial del virus. Para purificar parcialmente al BSMV-B se sigui� el procedimiento descrito en la figura 1. Este protocolo est� basado en la metodolog�a de Christie et al. (5) para concentrar part�culas virales, con algunas modificaciones de los autores. La siguiente descripci�n agrega algunas particularidades del procedimiento: las plantas fueron cosechadas a los 19-21 d�as despu�s de la inoculaci�n mec�nica (10), momento para el cual evidenciaban s�ntomas caracter�sticos de la infecci�n viral; sus hojas m�s j�venes fueron cortadas finamente y congeladas a -15 �C hasta su utilizaci�n (2-3 d�as despu�s de la cosecha).
Las hojas eran trituradas en una licuadora en presencia del buffer, en una relaci�n 1:2 (p/v), durante 5 min.
En el transcurso de la purificaci�n se utiliz� una centrifuga Sorvall RCL-B con un rotor SS-34. Todo el proceso se realiz� a una temperatura de 2-4 �C y no se hicieron ajustes de pH.
Pruebas de infectividad. Fueron realizadas con las siguientes fracciones de la purificaci�n: a) sobrenadante descartado despu�s de la precipitaci�n con polietilenglicol; b) �ltimo sedimento descartado; y c) suspensi�n parcialmente purificada (figura 1). Cada una de estas fracciones fue inoculada mec�nicamente en plantas j�venes (7-8 d�as de edad) de Phaseolus lunatus L. cv Henderson Bush, en el cual el BSMV-B induce lesiones locales necr�ticas (13). Tambi�n fueron inoculadas plantas de P. vulgaris cv Tacarigua, la cual manifiesta s�ntomas t�picos de mosaico ante la infecci�n con este virus (8).

Figura 1. Esquema de purificaci�n parcial del BSMV-B.
Obtenci�n del antisuero. Para obtener el antisuero contra el BSMV-B se inmuniz� un conejo de la raza Nueva Zelanda de 52 d�as de edad. Previo a la inmunizaci�n se obtuvo el suero normal, con la finalidad de constatar que el conejo a inmunizar no presentaba anticuerpos contra el BSMV-B. Adem�s este tipo de suero es utilizado en las pruebas serol�gicas como control.
a) Suero normal. Para obtener el suero normal, al conejo se le afeit� la oreja derecha, se le desinfect� con alcohol et�lico al 70%, se le dilataron las venas con xilol y se le aplic� vaselina para evitar que la sangre se dispersara en el borde de la oreja. El corte se realiz� en la vena marginal, pr�xima a la base de la oreja, permitiendo que la sangre goteara hacia tubos de vidrio est�riles. Seguidamente la sangre colectada se dej� durante 3 h bajo condiciones de laboratorio. Al cabo de ese tiempo se separaron cuidadosamente los co�gulos de las paredes de los tubos utilizando una varilla de vidrio est�ril; los tubos fueron colocados en un refrigerador a 4 �C hasta el d�a siguiente (3, 15).
El suero fue separado de los co�gulos y centrifugado a 3000 g durante 15 min. Por cada mililitro de suero normal se le agreg� una gota de azida de sodio al 1% como preservativo y se guard� congelado a -15 �C hasta su utilizaci�n (3).
b) Inmunizaci�n del conejo y tratamiento del antisuero. A los tres d�as despu�s de la extracci�n de la sangre para obtener el suero normal se inici� el proceso de inmunizaci�n. Al conejo se le suministraron cinco inyecciones intramusculares que conten�an 1 mL de suspensi�n viral + 1 mL de adyuvante incompleto de Freund a intervalos de seis d�as (3,15). La mezcla de ant�geno y adyuvante se efectu� minutos antes de cada inyecci�n.
La extracci�n de la sangre se realiz� de la siguiente manera: a) Un sangrado preliminar para conocer si el animal hab�a producido anticuerpos suficientes; �ste se efectu� cuatro d�as despu�s de la tercera inyecci�n. Se sigui� el procedimiento descrito en la obtenci�n del suero normal. b) El sangrado propiamente dicho se efectu� a los 11 d�as despu�s de la �ltima inyecci�n, mediante punci�n card�aca (3). En ambos casos la sangre fue tratada en la forma descrita para la obtenci�n del suero normal.
Al suero normal y al antisuero obtenido contra el BSMV-B se les determin� el t�tulo a trav�s de pruebas serol�gicas de doble difusi�n en agar (2). Para ello se hizo reaccionar diferentes diluciones de los sueros con diferentes diluciones de los ant�genos, y se determin� la m�xima diluci�n del antisuero capaz de detectar su hom�logo (15).
c) Absorci�n o saturaci�n del antisuero. Para absorber o saturar el antisuero se prepar� una suspensi�n de prote�nas de planta sana, macerando hojas j�venes de plantas de caraota (19-21 despu�s de la siembra) en un mortero fr�o y est�ril, sin adici�n de otras sustancias; el extracto era filtrado a trav�s de gasa y centrifugado a 3.000 g por 15 min. A partir del sobrenadante fueron preparadas varias diluciones (1/2, ... 1/16) con buffer fosfato de potasio 0,001 M, 0,85% NaCl, pH 7,5; cada una de ellas fue mezclada con igual volumen de antisuero (0,2 mL) y mantenidas a 4 �C durante 12 h. Luego, las diluciones fueron centrifugadas a 3.000 g por 15 min para eliminar precipitados. Cada diluci�n se prob� contra prote�na de planta sana a trav�s de pruebas de doble difusi�n en agar, con el fin de determinar la diluci�n m�s alta capaz de absorber todos los anticuerpos contra este tipo de prote�nas presentes en el antisuero. Una vez absorbido el antisuero, fue mezclado con glicerol en proporci�n 1:1 (v/v) y almacenado a -15 �C.
Serolog�a. Se utiliz� el m�todo de doble difusi�n en agar o de Ouchterlony (2). El medio de inmunodifusi�n consisti� de 0,8% de agar purificado, 0,85% de cloruro de sodio y 0,1% de azida de sodio en agua destilada. Una vez preparado el medio, 12-15 mL eran vertidos en cada caja de Petri pl�stica de 100 mm x 15 mm. Los huecos realizados en el gel med�an 5 mm de di�metro y estaban equidistantes entre si, separados 5 mm de un hueco central de igual medida (2).
Cuando se utiliz� material vege-tal infectado como ant�geno, las hojas j�venes de plantas de caraota (19-21 d�as despu�s de inoculadas) fueron maceradas en un mortero fr�o y est�ril, sin agregar buffer, y el extracto era filtrado a trav�s de gasa y centrifugado a 3.000 g por 15 min. El sobrenadante era utilizado en las pruebas. El testigo era obtenido de igual forma, pero a partir de plantas sanas.
Microscop�a electr�nica. Para corroborar la forma y tama�o de las part�culas virales, as� como para comprobar la concentraci�n viral en la suspensi�n parcialmente purificada, se procedi� de la siguiente manera: sobre una rejilla de cobre cubierta con una pel�cula muy delgada de nitrocelulosa (colodi�n) y carb�n evaporado se coloc� una gota de suspensi�n viral diluida y se dej� durante 1 min. Luego, se elimin� el exceso de l�quido de la rejilla con un papel filtro, se colore� con una gota de acetato de uranilo y despu�s de 2 min se elimin� el exceso de colorante con un papel filtro. Una vez seca la rejilla, aproximadamente a los 15 min, se observ� al microscopio electr�nico de transmisi�n (5, 10).
Resultados y discusi�n
En plantas de caraota `Tacarigua' el virus se multiplic� eficientemente, lo cual se evidenci� en las preparaciones a partir de la suspensi�n parcialmente purificada observadas al microscopio electr�nico. Una alta concentraci�n de part�culas isom�tricas de 28-30 nm de di�metro, caracter�sticas del BSMV (9, 13), fueron observadas en todos los preparados realizados con material de las diferentes purificaciones (figura 2).
El procedimiento implementado para purificar parcialmente al BSMV-B permiti� alcanzar los resultados esperados. Aunque no se determin� el rendimiento viral a partir del tejido vegetal, los resultados de las pruebas de infectividad evidenciaron que despu�s del proceso de precipitaci�n con polietilenglicol (PEG) la cantidad de part�culas virales que permanecieron en el sobrenadante descartado fueron escasas. Sin embargo, despu�s de resuspender el sedimento obtenido y centrifugar, a�n persist�a en el nuevo sedimento que se descarta cierta cantidad de viriones (cuadro 1). Probablemente esto ocurre por restos de PEG que quedan en el sedimento resuspendido y que hace que precipiten nuevamente algunas part�culas al centrifugar. Esto no afect� considerablemente el rendimiento final, ya que en la suspensi�n parcialmente purificada se observ� una alta concentraci�n de part�culas virales, lo cual fue evidenciado a trav�s del microscopio electr�nico (figura 2) y las pruebas de infectividad (cuadro 1).
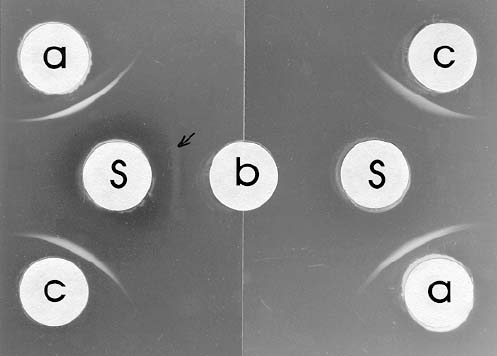
Figura 2. Part�culas del BSMV-B observadas al microscopio electr�nico a partir de una suspensi�n parcialmente purificada diluida 1:3. La barra representa 100 nm.
Cuadro 1. Pruebas de infectividad sobre Phaseolus lunatus cv Henderson Bush de algunas fracciones de la purificaci�n parcial.1
| Fracci�n | Reacci�n2 |
| Sobrenadante descartado despu�s de la precipitaci�n con polietilenglicol | + |
| Ultimo sedimento descartado | ++ |
| Suspensi�n parcialmente purificada | +++ |
1Evaluaci�n realizada a los cuatro d�as despu�s de la inoculaci�n mec�nica. Fueron inoculadas tres plantas con cada fracci�n.
2+ = 1 a 2 lesiones locales necr�ticas(LLN)/hoja; ++ = 3 a 8 LLN/hoja. +++ = m�s de 9 LLN/hoja.
Estos resultados coinciden con lo citado por Christie et al.(5), quienes lograron aumentar el n�mero de part�culas observables en el microscopio electr�nico mediante un protocolo sencillo de concentraci�n para diferentes virus. La metodolog�a desarrollada en este estudio logr� ese objetivo, aparentemente en mayor cuant�a, lo cual es de gran inter�s para la obtenci�n de antisuero. Por otra parte, es importante destacar que durante el proceso de purificaci�n las part�culas virales no perdieron su infectividad, ya que las fracciones evaluadas indujeron s�ntomas caracter�sticos de la enfermedad sobre P. lunatus cv Henderson Bush (lesiones locales necr�ticas) y P. vulgaris cv Tacarigua (mosaico).
El t�tulo del suero normal fue cero, lo que evidencia que el conejo no presentaba anticuerpos contra un pat�geno hom�logo. En pruebas de doble difusi�n en agar se observ� una banda de precipitaci�n muy evidente entre el ant�geno viral (BSMV-B) y su antisuero. Sin embargo, tambi�n se observ� una banda muy tenue con prote�na de planta sana (figura 3), lo que demuestra que la purificaci�n del BSMV-B no fue total, quedando alg�n remanente de prote�na vegetal. Este resultado era de esperarse, ya que se utiliz� un protocolo sencillo de �purificaci�n�. Otros investigadores (1, 11, 14, 15) tambi�n han obtenido resultados similares con otros virus, recurriendo a la absorci�n del antisuero para eliminar los anticuerpos no espec�ficos contra el virus.
El t�tulo del antisuero para el primer y segundo sangrado fue de 1:1024. Es decir, que tres inyecciones eran suficientes para obtener un suero con el mismo t�tulo. Esto es debido en gran parte a que el BSMV es altamente inmunog�nico (13) y la concentraci�n de part�culas en cada inyecci�n era alta (1 mL de suspensi�n viral parcialmente purificada). Como el antisuero obtenido no fue completamente espec�fico, fue necesario absorberlo o saturarlo con prote�na de planta sana. Con una diluci�n de 1:4 de la prote�na de planta sana obtenida (utilizando el antisuero como diluente) se logr� precipitar todos los anticuerpos no espec�ficos, observ�ndose �nicamente la formaci�n de banda de precipitaci�n correspondiente al ant�geno viral y sus anticuerpos, sin reacci�n simult�nea con la prote�na vegetal (figura 3). Despu�s de la absorci�n del antisuero el t�tulo fue de 1:512.
La reacci�n del antisuero absorbido sin diluir fue positiva (banda de precipitaci�n bien visible), tanto con las suspensiones virales parcialmente purificadas, como con savia de plantas infectadas. Sin embargo, en este �ltimo caso las bandas fueron ligeramente m�s tenues, debido a que la concentraci�n viral era considerablemente menor con respecto a las suspensiones parcialmente purificadas (figura 3).
El antisuero absorbido permiti� detectar f�cilmente al BSMV-B en muestras procedentes del campo (plantas j�venes y viejas) mediante pruebas serol�gicas de doble difusi�n en agar. Este tipo de prueba permite detectar a este virus con bastante precisi�n, debido a que no est� relacionado serol�gicamente con otros miembros del grupo sobemovirus, ni con otros virus pertenecientes a otros grupos. No obstante, todas las razas del BSMV est�n relacionadas serol�gicamente entre s� (13). Por otra parte, ser�a interesante probar el antisuero obtenido a trav�s de otras t�cnicas serol�gicas m�s sensibles, como ELISA, ya que el t�tulo del mismo es relativamente alto y se utilizar�a menos antisuero.

Figura 3. Prueba de doble difusi�n en agar utilizando antisuero (S) contra el BSMV-B: sin absorber (izquierda) y absorbido (derecha). Los huecos perif�ricos conten�an virus parcialmente purificado (a) y savia de plantas de caraota: sanas (b) e infectadas con BSMB-B (c).
Algunos investigadores (4, 6, 7) han obtenido antisueros contra el BSMV con t�tulos de 1:512, determinados mediante pruebas de doble difusi�n en agar. Estos sueros han sido obtenidos mediante metodolog�as que hacen uso de equipos especializados de alto costo, las cuales han tenido como base la precipitaci�n de las prote�nas mediante el uso de ultracentr�fugas. Sin embargo, en esta investigaci�n, con una metodolog�a sencilla y sobre la base de la precipitaci�n de las prote�nas con polietilenglicol, se ha obtenido un antisuero con igual t�tulo, lo cual es de gran inter�s en nuestras condiciones. Por otra parte, ser�a importante evaluar este protocolo para otros virus de caracter�sticas similares y estudiar la posibilidad de obtener antisueros.
En conclusi�n, los resultados obtenidos en este trabajo coinciden con lo logrado por Alagares et al. (1), Ochoa y Trujillo (11) y Trujillo et al. (14); es decir, se pueden obtener antisueros contra algunos virus de plantas mediante t�cnicas simples y en laboratorios modestos. En tal sentido, la obtenci�n de antisuero contra el BSMV-B mediante una metodolog�a sencilla puede ser de gran ayuda en el diagn�stico y estudios sobre la epidemiolog�a de este virus, particularmente en laboratorios o pa�ses que confronten problemas econ�micos para la obtenci�n de materiales y equipos.
Agradecimientos
Los autores desean expresar su gratitud al Dr. E. Debrot, Lic. M. Alfaro y Tecn. F. Centeno (Fonaiap-Ceniap, Laboratorio de Virolog�a Vegetal, Maracay) por su valiosa ayuda en la parte de microscop�a electr�nica. Igualmente, a la profesora L. Fari�as (UCV, Fac. Agronom�a, Laboratorio de Enzimolog�a, Maracay), por permitir el uso de algunos equipos y materiales.
Literatura citada
1. Alagares, M., G. E. Trujillo, M. J. Garrido y C. M. de Jim�nez. 1988. Algunos aspectos relacionados con el virus del mosaico severo del frijol (Vigna unguiculata (L.) Walp). Fitopatol. Venez. 1 : 25-26 (Resumen).
2. Ball, E. M. 1990. Agar double diffusion, plates (Ouchterlony): Viruses. p. 111-120. In: R. Hampton, E. Ball, and S. De Boer (Eds.). Serological methods for detection and identification of viral and bacterial plant pathogens. APS Press, Minnesota, EE.UU.
3. Ball, E. M., R. O. Hampton, S. H. De Boer, and N. W. Schaad. 1990. Polyclonal antibodies. p. 33-54. In: R. Hampton, E. Ball, and S. De Boer (Eds.). Serological methods for detection and identification of viral and bacterial plant pathogens. APS Press, Minnesota, EE.UU.
4. Cupertino, F. P, M. T. Lin, E. W. Kitajima, and C. L. Costa. 1982. Occurrence of southern bean mosaic virus in Central Brazil. Plant Disease 66 : 742-743.
5. Christie, S. R., D. E. Purcifull, W. Crawford, and N. A. Hamed. 1987. Electron microscopy of negatively stained clarified viral concentrates obtained from small tissue samples with appendices on negative staining techniques. IFAS, University of Florida, Gainesville. Bulletin 872. 45 p.
6. Grogan, R.G. and K. A. Kimble. 1964. The relationship of severe bean mosaic virus from M�xico to southern bean mosaic virus and its related strain in cowpea. Phytopathology 54 : 74-78.
7. Lamptey, P. and R. Hamilton. 1974. A new cowpea strain of southern bean mosaic virus from Ghana. Phytopathology 64 : 1100-1104.
8. Mora, O., G. E. Trujillo, O. Borges y R. de Uzc�tegui. 1988. Mosaico sure�o de la caraota (southern bean mosaic virus) afectando a Phaseolus vulgaris en Venezuela. Fitopatol. Venez. 1 : 29 (Resumen).
9. Morales, J. F. and R. G�mez. 1989. Beetletransmitted viruses. p. 363-377. In: H. F. Schwartz and M. A. Pastor-Corrales (Eds.). Bean production problems in the tropics. 2nd. ed. CIAT. Cali, Colombia.
10. Noordam, D. 1973. Identification of plant viruses. Methods and experiments. Center for Agricultural Publishing and Documentation. Wageningen, Holanda.
11. Ochoa, F. y G. E. Trujillo. 1994. Metodolog�a sencilla para la obtenci�n de antisuero al virus de la tristeza de los c�tricos. Fitopatol. Venez. 7 : 2-5.
12. Pati�o, Y. y M. J. Garrido. 1996. Identificaci�n y detecci�n del virus del mosaico sure�o de la caraota en varias localidades del estado Aragua, Venezuela. Fitopatol. Venez. 9 : 16-17.
13. Tremaine, J. H. and R. I. Hamilton. 1983. Southern bean mosaic virus. Descriptions of plant viruses No. 274. CMI/AAB. Kew, Surrey, England. 6 p.
14. Trujillo, G. E., M. J. Garrido y M. Alagares. 1989. Un modo f�cil de obtener antisueros a diferentes virus vegetales. p. 21-22. En: Memoria II Jornadas de Investigaci�n de la Facultad de Agronom�a, UCV. Maracay, Venezuela.
15. Van Regenmortel, M. H. V. 1982. Serology and inmunochemistry of plant viruses. New York, Academic Press.