
Rev. Fac. Agron. (LUZ). 1998, 15: 534-544
Control de Sclerotium rolfsii Sacc con fungicidas y humus
Control of Sclerotium rolfsii Sacc with fungicides and humus
Recibido el 28-07-1998lAceptado el
12-11-1998
1. Unidad Técnica Fitosanitaria-Instituto de Investigaciones Agronómicas, Facultad de
Agronomía, La Universidad del Zulia.
2. Facultad de Agronomía. La Universidad del Zulia.
3. Departamento de Estadística. Facultad de Agronomía. La Universidad del Zulia.
Apartado 526. Maracaibo 4005, Zulia. Venezuela.
R. Ramírez1, R. Santos1, F. Bracho1, L. Sandoval2 y C. Castro de Rincón3
Resumen
Palabras claves: Lycopersicon esculentum, tomate, Sclerotium rolfsii,
fungicidas, humus, control integrado.
Abstract
Key words: Lycopersicon esculentum, tomato, Sclerotium rolfsii,
fungicides, humus, integrated control.
Introducción
El hongo Sclerotium rolfsii Sacc., patógeno causante de la pudrición blanca, ha sido reportado a nivel mundial afectando a más de 180 cultivos diferentes en zonas de clima tropical, subtropical y templado cálido, presentándose tanto al inicio como al final del ciclo del cultivo, debido a que es muy variado en sus hábitos de crecimiento: crece a temperaturas desde 8°C hasta 40°C y en pH desde 1,4 hasta 8,8, causando el acame de las plantas por la desintegración del tejido en la base del tallo donde se observa, inicialmente, un micelio blanquecino ramificado del cual se producen, finalmente, numerosos esclerocios encargados de su sobrevivencia y diseminación (1, 16).
En Venezuela se ha observado en diversas zonas agrícolas de los estados Cojedes, Guárico y Portuguesa atacando plantas de tomate, tabaco, ñame, pimentón, caraota, ajonjolí, batata, girasol y soya (2, 20).
En el control de S. rolfsii, el cual es difícil por la producción de esclerocios que sobreviven en el suelo por muchos años (6), se ha usado la aplicación de productos químicos al suelo, prácticas culturales, control biológico y combinaciones de estas prácticas. En el control químico in vitro se han obtenido resultados efectivos en la reducción del número de esclerocios con Vitavax (200), Terraclor®, Captan®, Thiram, Chloroneb, Carboxin®, Pentachloro-nitrobenceno (PCNB) y Triphenyltin hydroxide (TPTH), mientras que en el control químico con productos aplicados al suelo ha sido efectivo el Dichloronitroaniline (9, 19). En el uso de prácticas culturales se ha evaluado el tipo de suelo, variedades resistentes, frecuencia de riego, abonos verdes y energia solar (8, 17, 21, 15). En el control biológico se han realizado trabajos con diferentes especies de Trichoderma para evaluar su efecto en el número, tiempo de formación y porcentaje de parasitismo de esclerocios (3, 4, 14) y estudiar algunos factores del suelo que influencian su ataque a los esclerocios, así como, su capacidad como antagonista de este hongo (13, 23). Así mismo, in vitro se ha estudiado la influencia de fertilizantes químicos y abonos orgánicos en el crecimiento de los esclerocios (18) y se ha estudiado el uso del control integrado mediante hongos del género Trichoderma y fungicidas (15).
En el estado Zulia se ha observado a S. rolfsii en la zona hortícola de Carrasquero, infectando cultivos de tomate causando la pudrición basal del tallo y afectando severamente las siembras de tomate (7, 12), siendo favorecido por las condiciones del ambiente y por el sistema de manejo del cultivo de tomate se ha diseminado por toda la región provocando pérdidas cuantiosas al obtenerse rendimientos bajos y un producto de baja calidad. No existen experiencias sobre el control de este patógeno en el estado Zulia y ante la aparición de nuevos fungicidas, señalados por sus fabricantes como efectivos contra hongos productores de esclerocios, y de fertilizantes orgánicos como el humus líquido y el humus de lombrices, los cuales pueden inducir el aumento de la población nativa de microorganismos antagónicos presentes en el suelo, el presente trabajo tuvo como objetivo evaluar a nivel de invernadero el efecto de dos fungicidas, el Vinclozolin (Ronilan®) y Clorotalonil (Bravo 500®), y de humus líquido (Carbovit®) y humus de lombrices aplicados en forma individual y combinados, en el control de S. rolfsii, determinando el costo de cada tratamiento para seleccionar aquel mas efectivo y de menor costo en su aplicación.
Materiales y métodos
Recolección de suelo infectado: La muestra de suelo infectado (1 kg) fue colectada a una profundidad entre 0-20 cm de suelo sembrado con tomate de la finca El Venado ubicada en Carrasquero, municipio Páez, estado Zulia, con antecedentes de la presencia de la pudrición basal del tallo causada por S. rolfsii; esta zona presenta una temperatura promedio de 27°C, precipitaciones de 800 mm/año y suelos de textura franco a franco-arenoso (8). La muestra de suelo fue trasladada al laboratorio de diagnóstico de enfermedades de la Unidad Técnica Fitosanitaria (UTF), del Instituto de Investigaciones Agronómicas de la Facultad de Agronomía, de La Universidad del Zulia, para su procesamiento.
Extracción de esclerocios. La extracción de esclerocios del suelo se efectuó por la modificación del método de flotación de esclerocios (10). Se tomaron 50 g de suelo, 5 mL de dispersante (jabón líquido) y 250 mL de agua destilada, agitando y dejando reposar por 5 min para obtener los esclerocios por flotación. Posteriormente se procedió al filtrado y contaje de los mismos donde se obtuvo 1,2 esclerocios/50 g de suelo, lo que corresponde a un suelo infectado naturalmente (2).
Desinfección de esclerocios. Los esclerocios obtenidos del suelo fueron desinfestados superficialmente para eliminar hongos contaminantes con NaOCl al 0,1575 % (3 % del producto comercial) durante 1 min, antes de su siembra en un medio de papa-dextrosa-agar (PDA) para su germinación y crecimiento del micelio hasta la obtención de cultivos puros del hongo.
Preparación de semillero y transplante. Se construyó un semillero de 8 m2 con una mezcla de arena y abono orgánico en proporción 2:1, la cual se desinfectó con formol al 40%, a una dosis de 1,2 litros del producto en 40 litros de agua.
Para la siembra se utilizaron 2 g de semilla/m2 (5) de la variedad Río grande de tomate, variedad usada comúnmente en las zonas tomateras del estado Zulia. Al momento del transplante, realizado en la 5ta semana, se colocaron 7 plantas/bolsa de 5 kg que contenían suelo desinfectado en autoclave (15 lbs/pulg2 por 30 minutos) de las cuales se seleccionaron las 4 de mayor vigor para la realización del ensayo experimental. A las plantas se les aplicaron las prácticas culturales correspondientes de riego, fertilización, control de malezas, etc.
Inoculación de las plantas. En la 6ta semana después del transplante se procedió a inocular el suelo con 1,0 esclerocio/20 g de suelo en los 0 - 3 cm superficiales del suelo contenido en las bolsas, correspondiendo a cada una 38 esclerocios, aplicándose los tratamientos en este momento. En la semana 11va, cuando el tratamiento testigo presentaba un 50 % de plantas enfermas y/o muertas, se procedió a evaluar la eficacia de los tratamientos.
Diseño experimental. El ensayo experimental se realizó bajo un diseño de bloques al azar con 16 tratamientos y 4 repeticiones. El análisis estadístico de la información se realizó haciendo uso del programa Statistical Analysis System (SAS), efectuándose el análisis de la varianza mediante el procedimiento Proc GLM y las pruebas de medias para los efectos significativos se realizó por Tukey (21).
Los tratamientos estuvieron conformados por: T1: Vinclozolin (Ronilan®)-500 g/ha, T2: Clorotalonil (Bravo 500®)-2 L/ha, T3: Humus líquido (Carbovit®)-al transplante (2 cc/L) y al suelo (7 L/ha), T4: Humus de lombrices-400 kg/ha, T5: Vinclozolin + Clorotalonil, T6: Vinclozolin + Humus líquido, T7: Vinclozolin + Humus de lombrices, T8: Clorotalonil + Humus líquido, T9: Clorotalonil + Humus de lombrices, T10: Humus líquido + Humus de lombrices, T11: Vinclozolin + Clorotalonil + Humus líquido, T12: Vinclozolin + Clorotalonil + Humus de lombrices, T13: Vinclozolin + Humus líquido + Humus de lombrices, T14: Clorotalonil + Humus líquido + Humus de lombrices, T15: Vinclozolin + Clorotalonil + Humus líquido + Humus de lombrices, T16: Testigo (con esclerocios y sin fungicidas ni humus).
La parcela experimental estuvo compuesta por 320 bolsas distribuidas en 4 bloques, cada bloque con 80 bolsas a una densidad de 0,10m x 0,5m y un total de 320 plantas. La unidad experimental estuvo constituida por 5 bolsas/tratamiento (figura 1).
Variables evaluadas
Porcentaje de plantas sanas (PPS). El cálculo del PPS de cada tratamiento se determinó mediante la siguiente formula: PPS = (N° plantas sanas por bolsa / N° total de plantas por bolsa) × 100.
Las plantas sanas fueron determinadas tomando en cuenta las características de la enfermedad, visualizadas comúnmente, en la base del tallo y a nivel del sistema radical (1, 2).
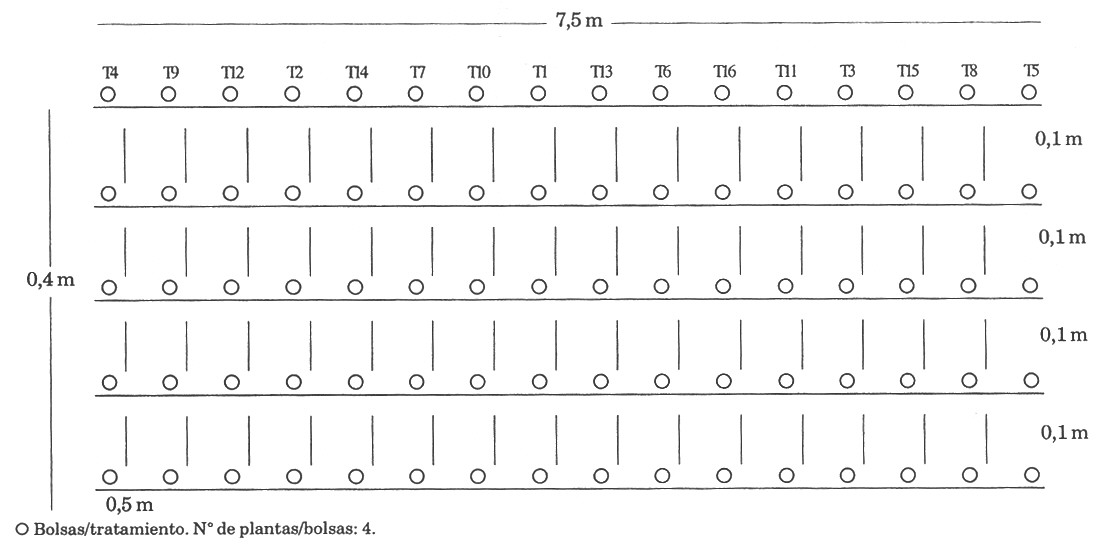
Figura 1. Diagrama del área (3 m2) correspondiente al bloque I y la distribución de los tratamientos.
Porcentaje de plantas enfermas (PPE). Para determinar el PPE de cada tratamiento se utilizó la formula siguiente: PPE = (N° plantas enfermas por bolsa / N° total de plantas por bolsa) × 100.
Se consideraron plantas enfermas aquellas donde se observó el micelio y esclerocios del hongo causando lesiones en la base del tallo de las plantas y en las raíces de las mismas, sintomatología característica del daño causado por el hongo S. rolfsii (1, 2).
Número de esclerocios. La variable número de esclerocios se determinó a través del porcentaje de control de esclerocios (PCE). Esto se realizó, restando a la población de esclerocios inoculados en el suelo antes de la aplicación de los tratamientos (EI), la población de esclerocios extraídos del suelo (muestra de 50 g/bolsa) después de finalizado el ensayo (EF), utilizando la siguiente formula: Porcentaje de control de esclerocios (PCE): PCE = [(EI _ EF) / EI] × 100.
Resultados y discusión
Porcentaje de plantas sanas (PPS). En el análisis de varianza para PPS se observó diferencias significativas (P<0,01) para el efecto de tratamientos. En la figura 2 se muestra la comparación de medias de tratamientos, observándose 5 grupos diferentes: el primer grupo lo integra el tratamiento donde se utilizaron los dos métodos obteniéndose una media de 91,56 % de plantas sanas; el segundo grupo lo conforma vinclozolin, clorotalonil, la combinación de vinclozolin + humus de lombrices + humus líquido, la combinación de vinclozolin + clorotalonil + humus líquido, la combinación de vinclozolin + clorotalonil + humus de lombrices, la combinación de clorotalonil + humus líquido + humus de lombrices, la combinación de clorotalonil + humus de lombrices, la combinación de vinclozolin + humus de lombrices, humus líquido y la combinación de clorotalonil + humus líquido, con medias que varían entre 69 y 86 % de plantas sanas; el tercer grupo está integrado por las medias de las combinaciones vinclozolin + clorotalonil (61,25%) y vinclozolin + humus líquido (61,11 %); el cuarto grupo lo integra la combinación de humus líquido + humus de lombrices (50,94%) y el quinto grupo corresponde para la no aplicación de ninguno de los métodos con una media de 24,15% de plantas sanas.
Esta distribución por diferencias de las medias de los tratamientos evaluados indica que el mejor tratamiento para controlar S. rolfsii es la aplicación de los dos métodos (cultural y químico). Sin embargo, la aplicación de vinclozolin y clorotalonil, humus de lombrices y humus líquido, en forma individual presentan menores medias que su combinación, controlando la enfermedad y cuyos valores de PPS están entre 69 a 86%, respectivamente.
Las combinaciones triples de estos productos fueron más eficientes en cuanto a PPS que las combinaciones dobles.
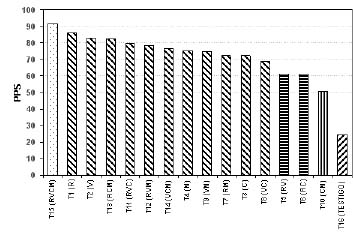
Figura 2. Prueba de medias para porcentaje de plantas sanas (PPS) para cada tratamiento. Barras con diferentes patrones difieren significativamente (P<0,05).
El menor PPS correspondió a la no aplicación de ninguno de los métodos, lo que significa que es necesario la utilización de métodos químicos y culturales, bien sea, combinados o en forma individual, para el control de S. rolfsii.
Estos resultados difieren de los reportados por Punja et al. (19) donde vinclozolin no fue efectivo en el control de esta enfermedad.
Porcentaje de plantas enfermas (PPE). En el análisis de varianza para PPE, existen diferencias significativas (P<0,01) entre los tratamientos. En la figura 3 se muestra la comparación de medias de los tratamientos. Se puede observar que las medias se distribuyen en tres grupos diferentes. El primer grupo lo constituye la media de la no aplicación de ninguno de los métodos, con un 75% de PPE. El segundo grupo lo integran las medias correspondientes a los tratamientos que combinan dos de los productos utilizados. Estas combinaciones son en orden decreciente de acuerdo a sus medias: humus líquido + humus de lombrices (47,50%), vinclozolin + humus líquido (38,89%) y vinclozolin + clorotalonil (38,75%). En este grupo se observa que las medias de PPE son menores al 50% pero mayores de 35 %. El tercer grupo, que contiene doce de los tratamientos, lo integran medias de las combinaciones cuádruple, triples y dobles, así como los tratamientos individuales. Todas estas medias muestran menos de 30 % de plantas enfermas, siendo la mayor del grupo la correspondiente a humus líquido (27,64 %) y la menor, a la combinación cuádruple (8,44%). Es de notar, como se dijo anteriormente para PPS, que vinclozolin y clorotalonil son los dos tratamientos que dan menores PPE después de la combinación cuádruple.
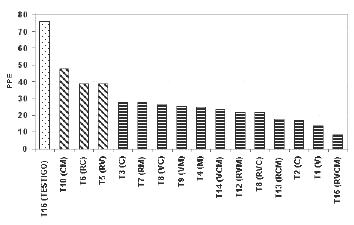
Figura 3. Prueba de medias para porcentaje de plantas enfermas (PPE) para cada tratamiento. Barras con diferentes patrones difieren significativamente (P<0,05).
Porcentaje de control de esclerocios (PCE). En el análisis de varianza para el PCE se detectó diferencias significativas (P<0,01) para el efecto de tratamientos. En la figura 4 se presentan las comparaciones de medias, observándose cuatro grupos: En el primer grupo encontramos el tratamiento correspondiente a la combinación de los dos métodos (químicos y cultural), el cual presentó el mayor porcentaje de control de esclerocios (86 %). El segundo grupo lo conforman nueve tratamientos que corresponden a las combinaciones triples y las combinaciones dobles y a los productos humus líquido, vinclozolin, y humus de lombrices presentando medias entre un 80 % y 48 %. El tercer grupo lo integran las medias de las combinaciones dobles de clorotalonil + humus líquido, vinclozolin + humus líquido, vinclozolin + clorotalonil, vinclozolin + humus de lombrices y clorotalonil. Para cualquiera de estos tratamientos el promedio de PCE fue menor de 45%. El cuarto grupo correspondió a la no aplicación de ningún método de control, el cual no presentó control de los esclerocios, ya que la inoculación se realizó con 2,5 esclerocios/50 g de suelo y se determinó una población promedio de 7 esclerocios/50g de suelo, lo que representa un aumento de tres veces de la población inicial.
Estos resultados sugieren que para obtener un control de los esclerocios es necesario la aplicación de algún método, bien sea, químico y/o cultural, siendo el más efectivo la aplicación combinada de todos ellos; sin embargo, la aplicación individual de humus líquido produce un control de los esclerocios mayor de 75% y la sola aplicación de vinclozolin un 66%.
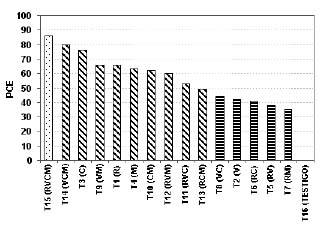
Figura 4. Prueba de medias para pocentaje de control de esclerocios (PCE) para cada tratamiento. Barras con diferentes patrones difieren significativamente (P<0,05).
Estos resultados difieren de los reportados por Punja et al. (19) y Flores et al. (11), donde vinclozolin no fue efectivo para inhibir la germinación, crecimiento y formación de los esclerocios de S. rolfsii.
Costo de la aplicación de los productos. En el cuadro 1 se presenta el costo de la aplicación de cada producto, bajo las condiciones del ensayo, utilizando el costo de cada producto para junio de 1998. La combinación del método químico (Vinclozolin y Clorotalonil) y cultural (Humus líquido y Humus de lombrices) presenta el mayor costo y mostró ser efectivo en el control de la pudrición basal. Vinclozolin, quién ocupó un segundo lugar en efectividad, presenta menor costo que la combinación de ambos métodos.
Debido a que los costos de los productos se elevan día a día, situación que no tiene límite, la recomendación del uso de estos productos debe hacerse con precaución, para no aumentar los costos de producción a niveles no rentables.
En este caso, la recomendación sería aplicar Vinclozolin en primer lugar y luego la combinación de los dos métodos de control que, a pesar de ser el de mayor costo, presentó el mayor PPS y PCE y menor PPE.
Cuadro 1. Costo de la aplicación de los tratamientos por hectárea (1).
| Tratamiento | Dosis/ha | Bs/kg ó Bs/L (*) | Bs/Aplicación | Costo total (2) |
| (T15) R+V+C+M | 170.583,25 | 173.583,25 | ||
| (T1) Vinclozolin (R) | 500 g | 9066,51 | 4.533,25 | 7.533,25 |
| (T2) Clorotalonil (V) | 2 L | 8410,00 | 16.820,00 | 19.820,00 |
| (T13) R+C+M | 153.763,25 | 156.763,25 | ||
| (T11) R+V+C | 50.583,25 | 53.583,25 | ||
| (T12) R+V+M | 141.353,25 | 144.353,25 | ||
| (T14) V+C+M | 166.050,00 | 169.050,00 | ||
| (T4) Humus de | ||||
| Lombrices (M) | 400 kg | 300,00 | 120.000,00 | 123.000,00 |
| (T9) V+M | 136.820,00 | 139.820,00 | ||
| (T7) R+M | 124.533,25 | 127.533,25 | ||
| (T3) Humus | ||||
| Líquido (C) | 0,4 L*-7 L** | 3950,00 | 29.230,00 | 35.230,00 |
| (T8) V+C | 46.050,00 | 49.050,00 | ||
| (T5) R+V | 21.353,25 | 24.353,25 | ||
| (T6) R+C | 33.763,25 | 36.763,25 | ||
| (T10) C+M | 149.230,00 | 152.230,00 |
Costo Jornal Aplicación = 3000 Bs. (1) Cálculos en base a una aplicación de cada producto. (2) Incluye el costo del producto y costo jornal aplicación. * Dosis para el transplante. ** Dosis primer riego. (*) Costo de cada producto para Junio/98.
Conclusiones
La aplicación combinada del método de control químico (Vinclozolin y Clorotalonil) con el método cultural (Humus líquido y Humus de lombrices) fue lo más efectivo para el control de Sclerotium rolfsii Sacc.
En aplicaciones individuales, el control químico resulta más eficiente que el control cultural.
En la relación beneficio-costo se recomienda aplicar Vinclozolin en primer lugar y luego, la combinación de los dos métodos de control.
Literatura citada
1. Agrios, G. 1985. Fitopatología. México. Editorial Limusa. p. 513-515.
2. Arcia, A. y I. Rodríguez. 1993. Incidencia y densidad de inóculo (esclerocios) de Sclerotium rolfsii Sacc en fincas tabacaleras ubicadas en El Sombrero, estado Guárico y en La Misión, estado Portuguesa. p. 62. En: Compendio de resúmenes del XIII Congreso Venezolano de Fitopatología. 07-11 Noviembre, San Cristobal, Táchira. Venezuela.
3. Arcia, A y I. Rodríguez. 1993. Efectos de doce aislamientos de Trichoderma spp sobre el número, tiempo de formación y porcentaje de parasitismo de esclerocios de Sclerotium rolfsii Sacc, en cuatro temperaturas diferentes. p. 82. En: Compendio de resúmenes del XIII Congreso Venezolano de Fitopatología. 07-11 Noviembre, San Cristobal, Táchira. Venezuela.
4. Arcia, A y I. Rodríguez. 1993. Influencia de diferentes concentraciones de conidios de Trichoderma spp en el control de Sclerotium rolfsii Sacc. p. 81. En: Compendio de resúmenes del XIII Congreso Venezolano de Fitopatología. 07-11 Noviembre, San Cristobal, Táchira. Venezuela.
5. Baptista, R y E. Felipe. 1985. Densidad de siembra y nivel de fertilización en almácigos de Tomate (Lycopersicon esculentum Mill). Revista de la Facultad de Agronomía. (Maracay) 16(2): 115-132.
6. Brown, E.A. and F. F. Hendrix. 1980. Distribution and control of Sclerotium rolfsii on apple. Plant Disease 64: 205-206.
7. Castellano, G. 1991. Evaluación de enfermedades de importancia económica de solanáceas en los municipios Mara y Paéz, estado Zulia. p. 100. En: Compendio de resúmenes del XII Congreso Venezolano de Fitopatología. 17-22 Noviembre, Maturín, Monagas. Venezuela.
8. Chima, W. and R. Wokocha. 1987. Effect of soil type on the damping of tomato seedlings caused by Sclerotium rolfsii Sacc in the Nigerian savanna. Plant and Soil 98(3): 443-444.
9. Diomande, M and M. K. Beute. 1977Comparison of soil plate fungicide screening and field efficacy in control of Sclerotium rolfsii on peanuts. Plant Disease Reporter 61:408-412.
10. Dhingra, O and J. Sinclair. 1986. Basic Plant Pathology Methods. C.R.C. Press. Florida, U.S.A. p. 77.
11. Flores, Y., A. Rondón, E. Soto y Y. Mujica. 1993. Control químico en condiciones in vitro de Sclerotium rolfsii Sacc causante de la pudrición blanca. p. 114. En: Compendio de resúmenes del XIII Congreso Venezolano de Fitopatología. 07-11, Noviembre, San Cristobal, Táchira. Venezuela.
12. Garcia, E. y L. López. 1993. Evaluación in vitro de hongos del suelo como agentes de control biológico de Sclerotium rolfsii Sacc, causante de la pudrición basal del tomate. Resúmen Nº 53.V Jornadas Técnicas Cientificas de la Facultad de Agronomía. Rev. Fac. Agron. (LUZ) 10 (1): 77.
13. Henis, Y and C. Papavizas. 1983. Factors affecting germinability and susceptibility to attack of sclerotia of Sclerotium rolfsii by Trichoderma harzianum in field soil. Phytopathology 73 (10): 1479-1474
14. Henis, Y. , P. B. Adams, J. A. Lewis, and G. C. Papavizas. 1983. Penetration of sclerotia of Sclerotium rolfsii by Trichoderma spp. Phytopathology 73 (7): 1043-1046.
15. Montealegre, J. y J. Henríquez. 1990. Posibilidades de control integrado de Sclerotium rolfsii Sacc. Mediante hongos del género Trichoderma y fungicidas. Revista Fitopatología. Universidad de Chile 25 (2): 68-74.
16. Mordue, J.E. 1974. Corticium rolfsii. Kew. England. Commonwealth Mycologycal Institute. Description of pathogenic fungi and bacteria N° 410. 4 p.
17. Pino, M. 1989. Evaluación de la problemática fitopatológica del cultivo del tomate en la zona de influencia del sistema de riego Cariaco. Fitopatología Venezolana 2(2): 51.
18. Prassad, B. K., T. S. P. Shinha and A. Prassad. 1986. In vitro studies on the influence of chemical fertilizers, organic manures and some cations on the growth of Sclerotium rolfsii Sacc isolated from tomato fruits. Indian Journal of Mycology and Plant Pathology 16(2): 215-217.
19. Punja, Z. K., R. G. Grogan and T. Unruh. 1982. Chemical control of Sclerotium rolfsii on golf Greens in northern California. Plant Disease 66: 108-111.
20. Rondón, A., Y. Flores, E. Soto y Y. Mujica. 1995. Control químico in vitro y en umbráculo del hongo causante de la pudrición blanca. Rev. Fac. Agron. (LUZ) 12 (1): 1-13.
21. SAS Institute, Inc. 1985. SAS User´s guide: Statistics. 5th edition. SAS Inst., Inc., Cary, NC.
22. Tu, C.C., Y. Cheng, and S. C. Hwang. 1987. Effect of solar energy and green manures on the control of de southern blight of tomato. Research Bolletin Tainan District Agricultural Improvemennt Station 21, p. 33-41.
23. Wells, H. D, K. Durham, and A. J. Casimir. 1972. Efficacy of Trichoderma harzianum as a biocontrol for Sclerotium rolfsii. Phythopatology 62: 442-49.