
Rev. Fac. Agron. (LUZ). 1999, 16 Supl. 1: 49-55
Comparación in vitro del control químico y biológico de Dothiorella sp., causante de la pudrición apical de la guayaba (Psidium guajava L)
Comparison in vitro of the control chemical and biological of Dothiorella sp., causing of the apical soft of the guava (Psidium guajava)
Recibido el 15-04-1999 l Aceptado
el 16-09-1999
1. trabajo de Investigación de tesis de Grado para Magister Scientiarum de
Jaqueline JHernández
2. Departamento de Agronomía de la Facultad de Agronomía de La Universidad del
Zulia. Apartado 526, Maracaibo. E-mail: [email protected]
3. Tutor de la tesis. Postgrado de Agronomía de La UCV. El Limón-Maracay.
4. Unidad Técnica Fitosanitaria, Facultad de Agronomía de La Universidad del
Zulia.
J. Hernández2, M. Arcia3 y R. Ramírez4
Resumen
Palabras clave: control biológico, Trichoderma, Dothiorella sp. Psidium
guajava L. Carbendazin
Abstract
Key words: biological control, Trichoderma, Dothiorella sp dothidea,
Psidium guajava L. Tricobiol®
Introducción
El cultivo de la guayabo (Psidium guajava L.), es uno de los frutales más importantes cultivados en el municipio Mara del estado Zulia, con una superficie sembrada de 4.000 hectáreas aproximadamente y un rendimiento de 30.000 kg/ha/año. Su fruto es apreciado no sólo para consumo fresco, por su alto contenido de vitamina C, sino también en la industria, para la elaboración de pulpa, concentrados, jugos, jaleas y compotas, tanto para el mercado nacional como internacional (2).
Desde 1984, cuando el cultivo del guayabo comenzó a establecerse comercialmente en el estado Zulia, la pudrición apical de la guayaba (PAG), comenzó a causar daños, acentuándose con el tiempo los problemas ocasionados por esta enfermedad (6).
Son varias las alternativas que se han planteado para solucionar este problema, entre las cuales se encuentra el control biológico mediante el uso de Tricobiolâ, fungicida biológico, formulado a base de Trichoderma harzianum. Dentro del género Trichoderma se encuentran los agentes de biocontrol más promisorios, debido a sus propiedades antagónicas a los hongos patogénicos de plantas, principalmente porque pueden localizarse en la rizósfera y colonizar y proteger las raíces de plantas. También se ha observado su efectividad en enfermedades foliares de un amplio rango de cultivos, así como en pudrición postcosecha de fruta de hueso (4, 5, 8, 10).
Una de las ventajas de Trichoderma como controlador biológico "poderoso", es la capacidad para atacar hongos patógenos en diferentes estados de desarrollo, como conidios, esclerocios e hifas (3).
A pesar de ser un habitante natural del suelo, tiene la capacidad de sobrevivir en el philoplano y en anthoplano (11, 7). El biocontrol es técnicamente factible para un amplio rango de enfermedades del follaje y frutos en varios sistemas de cultivo (12).
Lo et al. (9), compararon las poblaciones de Trichoderma del suelo y las del follaje, y observaron que en la última semana de evaluación las poblaciones del suelo disminuyeron de 6 a 5 unidades formadoras de colonia (UFC)/g suelo, mientras que las poblaciones del follaje se mantuvieron en 6 UFC/50 g de follaje, lo cual indica que en el ambiente aéreo Trichoderma tiene mayor capacidad de ocupar el nicho que el follaje le ofrece. Sin embargo, Andrew (1), señala que el éxito del biocontrol en la filosfera es más desafiante que en la rizosfera, y depende de los factores que afectan la capacidad de colonización y dominancia competitiva en la comunidad foliar.
El éxito del biocontrol se ha incrementado marcadamente en los últimos años, para patógenos que infectan flores, enfermedades del césped y patógenos en restos de cultivos (12).
El uso de Trichoderma como biocontrolador de la PAG, constituyen una herramienta nueva para la producción de guayaba, por lo que es necesario evaluar y profundizar en los aspectos de validación del producto, manejo, dosis, frecuencia de aplicación, para lograr tener así la solución a este problema que tantas perdidas a causado. Sin embargo, se tiene poca evidencia de las ventajas frente al producto químico que ha controlado medianamente la enfermedad. Por lo que el objetivo de este trabajo fue comparar in vitro el biocontrol por Trichoderma y el control químico por Carbendazim, de la PAG.
Materiales y métodos
Para el control In vitro se utilizaron tres técnicas: 1.- Dilución del fungicida en el medio del cultivo; 2.- Aplicación del fungicida en el centro de la placa de petri; y 3.- Inmersión del patógeno en una solución del controlador (fungicida químico o biológico).
La cepa del patógeno se aisló de un síntoma característico de la PAG cosechado en una granja comercial del municipio Mara del estado Zulia, y la cepa del Trichoderma se tomó del biofungicida comercial Tricobiol®.
Dilución del fungicida en el medio del cultivo.
Se tomó un disco de 5 mm de micelio de Trichoderma y se colocó en el centro de una cápsula de petri con papa dextrosa agar (PDA), con y sin fungicida diluido, justo al lado de un disco de Dothiorella sp. del mismo tamaño, La concentración del fungicida, 1 ppm de Carbendazin, se determinó de acuerdo a la técnica de Sharvelle, partiendo de la concentración del ingrediente activo del fungicida.
Aplicación del fungicida en el centro de la placa de petri. Se utilizaron colonias de Dothiorella sp. de tres días de edad, las cuales se horadaron en el centro con un sacabocado de 5 mm de diámetro, colocándose en el hoyuelo una suspensión del fungicida Carbendazin o de conidios del biocontrolador. La solución de los conidios de Trichoderma se realizó a partir de una colonia en crecimiento activo, de cinco días de edad, diluida en 500 ml de agua estéril, alcanzándose una concentración de Trichoderma fue de 3x106 conidios/ml, determinados con un hematocímetro. La concentración de Carbendazin fue 0,5 g/l.
Inmersión del patógeno en una solución del controlador.
Se tomó un disco de micelio de Dothiorella sp. y se sumergió por 10 segundos en soluciones de fungicida (control químico) y en una solución de conidios de Trichoderma (control biológico), con las concentraciones ya indicadas. El disco del patógeno tratado fue sembrado en una cápsula de petri con PDA.
Para las tres técnicas las cápsulas fueron incubadas a 25 °C aproximadamente y bajo luz continua. El crecimiento del hongo Dothiorella sp. se realizó cada 24 horas. Para el control biológico, no se estimó el crecimiento de Trichoderma sino el área de la colonia del patógeno que logró crecer.
El Diseño Estadístico fue un totalmente al azar con cinco repeticiones, la unidad experimental estuvo conformada por cada cápsula de petri. El análisis de varianza de los datos se calculó con el uso del paquete estadístico Statistix versión 1.0 para Windows.
Resultados y discusión
Al comparar in vitro el biocontrol y el control químico mediante los tres métodos: se observó control, tanto por el químico como por el biológico con los métodos 1 y 3, ya que en el método 2, la colonia del patógeno siguió desarrollándose a pesar de colocar en su centro la solución controladora.
A pesar de que con el método 1 se logró observar control tanto por Carbendazin (figura 1A), como por Trichoderma (figura 1B), pues en ambos casos se impidió el desarrollo del patógeno; no se pudo comparar ambos controles bajo las mismas condiciones, ya que en las placas del fungicida diluido no se logró desarrollar las colonias de Trichoderma, por lo tanto en estas placas el único que esta ejerciendo el control es Carbendazin.
Con el método 3, en el cual ambos controles se aplicaron de la misma forma, no se detectaron diferencias significativas entre el control químico y el biológico (gráfico 1). Lo que indica que esta enfermedad puede controlarse mediante el uso del biofungicida.
En el control biológico los conidios de Trichoderma contenidos en el disco de Dothiorella sp. luego de la inmersión en la solución biocontroladora, desarrollaron una colonia de Trichoderma, no permitiendo que se desarrollara la colonia de Dothiorella sp, (figura 2).
Se evidenció que Trichoderma controla igual que Carbendazin que ha logrado controlar el patógeno.
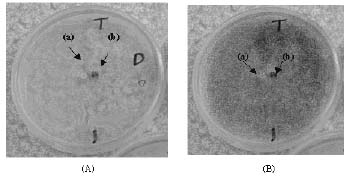
Figura 1. Comparación del control In vitro de Dothiorella por Trichoderma y Carbendazin, con el método: fungicida diluido en el medio. (A) Con fungicida diluido. (B) Sin fungicida diluido. (a) disco de micelio de Dothiorella (b). Disco de micelio de Trichoderma.
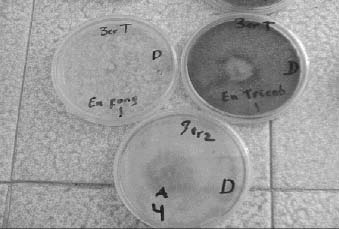
Figura 2 Comparación del control In vitro de Dothiorella por Trichoderma y Carbendazin, Con el método: Inmersión del patógeno en solución controladora
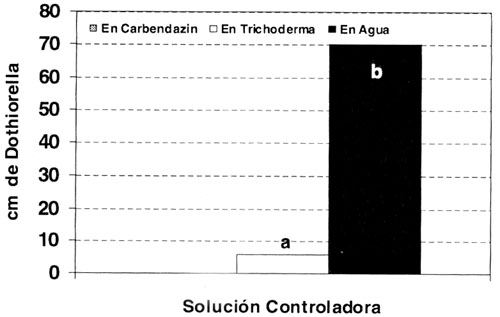
Letras distintas indican diferencias significativas, Prueba de Medias de Tukey
Figura 1. Comparación del control In vitro de Dothiorella por Trichoderma y Carbendazin
Conclusiones y recomendaciones
In vitro no se detectaron diferencias significativas entre el biocontrol por Tricobiol®, y el control químico por Carbendazim, para la Pudrición Apical de la guayaba (PAG), lo cual justifica el uso de Trichoderma como controlador no contaminante de esta enfermedad.
Para la comparación in vitro del control químico y el biológico de Dothiorella sp sp, causante de la PAG, la metodología más efectiva fue la de Inmersión del Disco del Patógeno en la solución controladora.
Bajo esta perspectiva, se recomienda evaluar el uso de Tricobiol, como producto comercial en plantaciones de guayabo, con el fin de validar su uso en el biocontrol de PAG y poder así entregarle al productor una herramienta de control que no dañe el ambiente ni la calidad de vida del productor y consumidor de esta fruta.
Literatura citada
1. Andrews, J. 1992. Biological control in the phyllosphere. Annu. Rev. Phytopathol. 30:603-635
2. Araujo, F.; S. Quintero; J. Salas; J. Villalobos y A. Casanova. 1997. Crecimiento y acumulación de nutrientes del fruto de guayaba (pisidium guajava L.) del tipo "Criolla Roja" en la planicie de Maracaibo. Rev. Fac. Agron. (LUZ) 14: 315-328.
3. Benhamou, N. y I. Chet. 1993. Hyphal interactions between Trichoderma harzianum and Rhizoctonia solani: Ultraestructure and Gold Cytochemistry of the mycoparasitic process. Phytopathology 83(10): 1062-1071.
4. Danielson, R. y C. Davey. 1973. The abundance of Trichoderma propagules and the distribution of species in forest soils. Soil Biology & Biochemistry 5(5): 485-494.
5. Hong, C., T. Michailides, y B. Holtz. 1998. Effects of wounding, inoculum density, and biological control agents on postharvest brown rot of stone fruits. Plant Disease 82(11):1210-1216.
6. Hernández, J., Isea, F., Arcia, A., y Santos, R. 1998. Primer Reporte del Control Biológico in vitro de Dothiorella sp sp dothidea. (Resumen). XLIV Reunión Anual de la Sociedad Interamericana de Horticultura Tropical. Barquisimeto - Venezuela.
7. Kovach, J. y J. Finkelstein. "Using honey bees disseminate Trichoderma harzianum to strawberries for Botrytis control". <http://www.nysaes.cornell.edu/ipmnet/ny/fruits/ papers/sberry_rpt.html>. Abril 1998.
8. Lo, C.; E. Nelson, y G. Harman. 1997. Improved biocontrol efficacy of Trichoderma harzianum 1295-22 for foliar phases of turf diseases by use of spray applications. Plant Disease 81(10):1132-1138.
9. Lo, C., E. Nelson, C. Hayes, y G. Harman. 1998. Ecological studies of transformed Trichoderma harzianum straim 1295-22 in the rhizosphere and on the phylloplane of creeping bentgrass. Phythopathology 88(2):129-136
10. Lorito, M.; G Harman, C. Hayes, R. Broadway, A. Tronsmo, S. Woo, y A. Di Pietro. 1993. Chitinolytic enzymes produced by Trichoderma harzianum: Antifungal activity of purified Endochitinase and Chitobiosdase. Phytopathology 83(3):302-307.
11. Nelson, M. y M. Powelson. 1988. Biological control of grey mold of snap beans by Trichoderma hamatum. Plant Disease 72(8):727-729.
12. Suton, J. y G. Peng. 1993. Manipulation and vectorinf of biocontrol organisms to manage foliage and fruit disease in cropping systems. Annu. Rev. Phytopathol. 31:473-493.